Desarrollo
de una crianza masiva de Stethorus histrio Chazeau, biocontrolador de la arañita
roja del palto (Oligonychus yothersi McGregor)
1. INTRODUCCIÓN
Entre
las múltiples plagas que afectan a las plantas cultivadas, los ácaros
constituyen un grupo que requiere una oportuna detección para evitar importantes
daños económicos.
Existen
factores supresores que mantienen normalmente en equilibrio las poblaciones de
los ácaros, los cuales se clasifican en dos tipos: factores bióticos y los
abióticos. Entre los primeros,
encontramos los enemigos naturales o biocontroladores (insectos, ácaros
depredadores, y enfermedades), y entre los segundos, el principal factor
regulador es el clima, siendo la temperatura la que desempeña el rol más
importante.
No
obstante, en la mayoría de los casos, el explosivo aumento de la población de
arañitas (ácaros) es una consecuencia de inadecuadas prácticas culturales, tales
como excesivas aplicaciones de pesticidas, que producen una masiva eliminación
de enemigos naturales.
De
acuerdo con MAGDAHL (1998), en nuestro país el cultivo del palto (Persea americana Mill.) alcanza una
superficie de 16.900 ha, siendo la Quinta Región, la zona que ha experimentado
el mayor incremento de superficie plantada (59,35% de la superficie
nacional). Esta expansión se centra
en la variedad Hass, cuya superficie representa el 70% del área total plantada
con paltos.
El palto es una de
las pocas especies que en nuestro país puede ser cultivado en cerro, debido a
que en estas áreas es poco probable que se presenten heladas (ya que el aire
frío, al igual que el agua, se desplaza rápidamente hacia los sectores
bajos). Por otra parte, esta
especie no sufre un gran número plagas o enfermedades que obliguen a controles
permanentes.
Sin
embargo y a pesar de lo anterior, una de las principales plagas de este frutal
es la arañita roja del palto (Oligonychus
yothersi (Mc Gregor)), que puede llegar a producir daños sólo cuando
alcanzan poblaciones excesivas, o cuando invaden el follaje nuevo en
expansión. Para evitar el daño en
el árbol, es necesario impedir que la población de este ácaro sobrepase el
umbral de daño económico.
Debido
a que gran parte del área donde se cultivan los paltos corresponden a cerros, es difícil pensar en un control
químico.
El
método de control biológico, es una alternativa viable para poder mantener la
densidad poblacional de esta plaga bajo el umbral de daño económico. Entre los enemigos naturales de este
ácaro, destaca el coleóptero coccinélido Stethorus histrio Chazeau, el cual es un
voraz depredador de todos los estadios de la arañita roja del palto. A pesar de su gran eficiencia, en
algunas ocasiones este depredador aparece tarde en la temporada, cuando las
poblaciones de las arañitas son muy elevadas, y ya han causado daño al
cultivo. Además, en zonas o áreas
con inviernos benignos, estos ácaros pueden sobrevivir alcanzando poblaciones
más abundantes al inicio de la primavera.
A
través del método de control biológico aumentativo, este depredador podría
liberarse tempranamente y en forma masiva, sobre la población de arañitas
realizando su control.
El
desconocimiento de antecedentes sobre la crianza masiva de Stethorus histrio, ha motivado el
desarrollo de esta investigación, con el fin de establecer un módulo de
crianza.
En
el presente trabajo, se han planteado los siguientes
objetivos:
v
Determinar
la factibilidad técnica de crianza de Stethorus histrio Chazeau en diferentes
épocas del año, bajo condiciones de invernadero
frío.
v
Determinar
la duración de todos los estadios del ciclo de vida de Stethorus histrio en condiciones de
confinamiento.
v
Determinar
el efecto de Stethorus histrio, sobre la población de la arañita roja
del palto.
2. REVISIÓN BIBLIOGRÁFICA
2.1.
Antecedentes generales de la plaga:
La
arañita roja del palto (Oligonychyus
yothersi (Mc Gregor)) pertenece al orden Acarina y a la familia
Tetranychidae. Esta familia, de acuerdo a DORESTE (1988), está formada por un
elevado número de especies fitófagas que se alimentan del contenido celular,
principalmente de las hojas en las cuales producen punteaduras blanquecinas que
llegan a causar el secado de las mismas, e incluso la defoliación de las
plantas.
Según
GONZÁLEZ (1989), esta especie tiene como hospedante primario al palto, y se han
descrito como secundarios a manzanos abandonados, membrilleros, sauce negro y,
raramente, eucaliptos.
La
arañita roja del palto y chirimoyo, O.
yothersi, es la única especie de
ácaros presente en paltos en la V Región, y su ataque ocurre preferentemente
sobre las especies conocidas como "californianas". En chirimoyos, es también la especie
predominante, frutal para el cual se cita, además, a Oligonychus ilicis (McGregor) (ROJAS,
1981).
A
partir de 1950, esta plaga fue adquiriendo mayor importancia, y la máxima
intensidad de ataques y daños se produjo entre 1955 y 1960, en la localidad de
la Cruz-Quillota, debido a varias razones tales como la reinjertación de paltos
chilenos, a los que ataca muy poco, con variedades californianas; la extensión
del cultivo a otras localidades; la aplicación de insecticidas para controlar el
trips, con lo que se eliminaron los enemigos naturales de la arañita, entre
otros (ROJAS, 1981). PRADO (1991),
la reporta distribuida desde la III a la VII Regiones.
La
arañita roja del palto es una especie que sólo provoca daños cuando alcanza
poblaciones excesivamente altas (sobre 50 individuos por hoja), o cuando invade
el follaje nuevo en expansión (brotes de otoño). En general, los ataques se inician en
los árboles de las orillas de los cuarteles, especialmente si hay caminos de
tierra (LÓPEZ, 1991).
LÓPEZ
(1997) ha descrito que la arañita roja del palto aparece en noviembre en algunos
huertos, estableciéndose en verano y alcanzando niveles de daño importantes de
marzo a abril.
2.1.1. Características biológicas de la
arañita roja del palto:
Las hembras de esta arañita tienen un cuerpo
algo ovalado y subgloboso, de aproximadamente 0,5 mm de largo, de color
anaranjado en el tercio anterior y rojo negruzco en el resto, con doce pares de
setas dorsales y un par de setas caudales, todas de color blanco y con patas del
mismo color del tercio anterior del cuerpo y setas blancas. El macho es más pequeño, delgado y de
color más pálido, con patas más largas que la hembra y con las mismas
características de setas (ROJAS, 1981).
La
postura es bien intensa especialmente en los meses de octubre y febrero-marzo,
donde es posible encontrar los mayores niveles de la población. Los huevos son esféricos, algo
achatados, con una ligera estriación radial provistos de un pedicelo dorsal,
largo y blanco amarillento; el color es rojo oscuro anaranjado. Son depositados en la cara superior de
las hojas junto a la nervadura central, quedando cubiertos por una ligera tela
compuesta por hilos blancos y sedosos entrecruzados (GONZÁLEZ,
1961).
Los
huevos de los tetraníquidos, al eclosionar, dan origen a una fase móvil de tres
pares de patas solamente, denominado larva. Posteriormente, se sucederían dos
estados ninfales de cuatro pares de patas, hasta llegar a adulto (VERA,
1994).
GONZÁLEZ
et al. (2000), menciona que en la especie O. punicae (Hirst.) no se presenta un
intervalo de madurez sexual, ya que ambos sexos pueden copular inmediatamente
después de su emergencia como adulto.
El
número de generaciones en el período de ataque se estima entre cuatro y cinco,
sobreviviendo de una temporada a otra, principalmente como adulto en diferentes
malezas (correhuela, malva, papilla, entre otras.) (ROJAS,
1981).
2.1.2. Daño:
Los
ataques en paltos y chirimoyos se producen en la cara superior de las hojas, de
preferencia a lo largo del nervio medio, extendiéndose en menor grado hacia los
laterales; en estos sectores de las hojas, se agrupan los huevos, ninfas y
adultos de arañitas, quedando protegidos por una delgada tela de hilos
blanquecinos (ROJAS, 1981).
El
efecto succionador de las arañitas, en sus diferentes estados de desarrollo,
sobre las hojas de paltos y chirimoyos, se traduce en un cambio notorio y
visible de coloración en los sectores atacados; del verde intenso, a una
coloración rojo- cobriza y un efecto de comba manifiesta desde los bordes de las
hojas hacia el nervio medio (ROJAS, 1981).
LÓPEZ
(1998), reporta que si las colonias se incrementan sin control y permanecen
alimentándose por mucho tiempo, pueden provocar la caída de hojas dañadas. Se
estima que para que esto ocurra, se requieren poblaciones por sobre las 70
hembras adultas de arañita por hoja, y por varias semanas. Las hojas totalmente
desarrolladas son capaces de fotosintetizar adecuadamente, aun cuando presenten
parte de la lámina decolorada, sin afectar los rendimientos. Investigaciones en Estados Unidos sobre
la especie Oligonychus punicae
(Hirst.) en paltos, señalan que se requieren por sobre un 46% de
decoloración del follaje, para que disminuya en un 30% la capacidad
fotosintética. Distinta es la situación cuando las colonias de arañitas llegan a
invadir los brotes de verano-otoño.
En estos casos, basta con colonias incipientes para que se provoque un
daño importante.
Trabajos realizados por McMURTRY y JOHNSON (1966)
en huertos de California,
determinaron que la caída de las hojas por una infestación con Oligonychus punicae, fue generalmente observada sólo cuando
la población alcanzaba un peak de sobre 700 hembras adultas por 10 hojas, o la
persistencia de más de 500 hembras adultas durante varias semanas. No se determinó si la parcial
defoliación reduce significativamente el desarrollo de los árboles y la
producción de la fruta, pero al parecer los árboles siempre continúan
vigorosamente su desarrollo en la primavera siguiente.
2.1.3. Dinámica
Poblacional:
Uno
de los factores que determina el carácter "plaga" de una especie, es la densidad
poblacional al momento del cultivo, por lo cual es tema fundamental estudiarlo
antes de diseñar las estrategias de control (LÓPEZ, 1993 citado por VERA,
1994).
El
estatus de plaga viene a ser una función del grado de ataque (o densidad
poblacional); del nivel de daño que provoque (en términos cualitativos y
cuantitativos) y el valor que el hombre le asigne al daño causado por la
población de esa especie (LÓPEZ, 1993 citado por VERA,
1994).
El
clima
es un factor (abiótico) muy importante que influye en la abundancia de esta
plaga. LÓPEZ (1997) indica que la temperatura determina la actividad diaria y la
velocidad con que se multiplican los ácaros. Por lo tanto, sus fluctuaciones a lo
largo del año explican la presencia y abundancia de esta plaga a partir de la
primavera, para aumentar en verano- otoño e iniciar una disminución en
invierno.
De
acuerdo a trabajo realizados por VERA (1994) en condiciones de campo, el ciclo
biológico de Oligonychus yothersi
McGregor presenta una duración promedio de 18 días en los meses de verano y
de 40 días en pleno invierno.
Los
Tetranychidae, en general, son favorecidos por tiempo caliente y seco, mientras
que una alta humedad en forma continua impide el aumento poblacional, y favorece
la muerte de los tetraníquidos durante las mudas (DORESTE,
1988).
Aunque
no existe una evaluación exacta de la lluvia, ésta es considerada un factor
supresor de las poblaciones de arañitas, de manera que en ausencia de ellas,
estos ácaros son capaces de alcanzar poblaciones mayores (LÓPEZ,
1997).
El
viento, que cumple una función
diseminadora, es capaz de arrastrar
arañitas de una planta a otra, o de un huerto a otro (LÓPEZ, 1997).
Trabajos
a nivel de campo realizados por McMURTRY y JOHNSON (1966) en California,
indicaron que declinaciones abruptas de
poblaciones de O. punicae fueron comúnmente asociadas con
factores bióticos tales como depredación, competencia intraespecífica, o una
combinación de ambos. Ellos determinaron, mediante ensayos realizados en
laboratorio, que la condición de la hoja hospedera es el factor que más afecta
el potencial reproductivo de Oligonychus
punicae. Los árboles de palto permanecen con sus hojas durante todo el año,
pero durante la primavera caen
algunas hojas viejas antes de
que las nuevas estén completamente abiertas.
Durante este período, raramente ocurre un aumento significativo de la arañita.
Poblaciones residuales permanecen en las hojas viejas y las hojas nuevas no son
prontamente colonizadas hasta que éstas comienzen a endurecerse y adquieran un
color verde oscuro. Por lo tanto, si
no son controladas por otros factores, finalmente la población se
autorregula.
2.2.
Antecedentes
generales del controlador:
Stethorus
histrio
Chazeau pertenece al orden Coleóptera y a la familia Coccinelidae. Según PRADO
(1991), los miembros de esta familia en nuestro país tienen una función
exclusivamente benéfica.
Algunos de los grandes coccinélidos han sido registrados como depredadores
de los ácaros, entre ellos Hippodamia
convergens Guérin y Olla abdominalis (Say), algunas especies
de los géneros Adalia, Eriopis,
Psyllobora y Scymnus (DORESTE,
1988).
Stethorus
es un insecto depredador de ácaros
de la familia Tetranychidae tales como la arañita roja europea (Panonychus ulmi (Koch)), la arañita
bimaculada (Tetranychus urticae
(Koch)), la arañita roja de los cítricos (Panonychus citri (Mc Gregor)), la falsa arañita de la vid (Brevipalpus chilensis Baker.), la
arañita roja del palto (Oligonychus
yothersi (Mc Gregor)) y la
arañita roja de la uva de mesa (Oligonychus vitis Zah.-Shen) (PRADO,
1991).
De
acuerdo con DORESTE (1988), entre
los coccinélidos, el género Stethorus, contiene solamente especies
depredadoras de ácaros especialmente tetraníquidos que son de distribución
mundial completa su ciclo de vida en dos semanas bajo condiciones de
temperaturas altas; entre las especies, se puede mencionar a Stethorus picipes Casey, S. punctum LeConte, S. punctillum Weise y S. utilus Horn.
En
1963, se constató en La Cruz la presencia de un nuevo depredador de arañitas,
identificado posteriormente como Stethorus sp.
(VERA,1994)
2.2.1. Descripción y Duración el Ciclo de
Vida del Genero Stethorus:
Trabajos
realizados por ANDERSON y GORGON (1979) han caracterizado morfológicamente adultos y larvas de Stethorus histrio. Los adultos tienen una forma ovalada no muy
convexos, son de tamaño muy diminuto: 1,0 a 1,2 mm de longitud y de 0,80 a 0,86
mm de ancho. El cuerpo es de color negro uniformemente brillante y cubierto con
finos pelos de un color amarillo. La hembra es similar al macho, excepto por
características sexuales como la ausencia de cápsula espermática, y el plato genital es tranversalmente
oval; además, el ápice del último esternón abdominal es redondeado. Sthetorus histrio Chazeau, posee cuatro
estados larvales, donde existen
diferencias como la pigmentación de la cabeza y suturas frontales que permiten
separar entre el cuarto y segundo estadio larval. Las larvas son de un color pardo anaranjado, con manchas
oscuras en el dorso, de 1,6 a 1,9 mm de longitud, cabeza subcuadrada y más
angosta que larga.
Los
huevos son oblongo-ovoide, de color anaranjado y las hembras oviponen
individualmente en el haz de las hojas, en sectores de alta densidad de las
arañitas (VERA, 1994).
De
acuerdo con HULL (1995), los huevos
de Stethorus punctum (LeConte) son muy pequeños de unos 0,5 mm
aproximadamente, de color blanco y
ovalados y llegan a ser negruzcos momentos antes de que emerja la larva. Éstos son depositados mayoritariamente
en el envés de la hoja, cercano a las venas primarias.
Según
investigaciones llevadas a cabo por PUTMAN (1955) en Ontario, las hembras de Stethorus punctillum permanecen en el
follaje de árboles de duraznero altamente infestado con arañita roja europea (Panonychus ulmi), donde ellas oviponen
cerca o en las colonias de arañitas, principalmente en la cara inferior de las
hojas.
Los
huevos recientemente ovipuestos de S.
picipes fueron blanco-cremosos, de forma oval y de una longitud de 0,30 a
0,35 mm. Mediante un proceso de
embriogénesis, los huevos gradualmente comienzan a volverse rosados, coloración
que aparece después del segundo día de incubación. Dos ojos en el polo animal comienzan a
evidenciarse al tercer día. Pronto, los huevos adquieren una coloración gris
cuando se acerca el momento de la eclosión (TANIGOSHI y McMURTRY, 1977)
El
ciclo biológico de Stethorus histrio
Chazeau, bajo condiciones de laboratorio mostró una duración promedio de 15 días, a una temperatura promedio
de 23ºC,y un período de luz oscuridad de 12 horas. Cabe señalar que las estapas de
incubación y crisalidación presentaron una duración promedio de 5 y 4 días,
respectivamente (VERA, 1994).
En
ensayos hechos por TANIGOSHI y McMURTRY (1977), en laboratorio a 22-26ºC, el período de incubación de
huevos de S. picipes promedio los 3,85 días para las hembras y
de 4,00 días para los machos. El
tiempo promedio de desarrollo de los estadios larvales fue de 9,50 y 9,55 días
para hembras y machos, respectivamente.
Aproximadamente un día antes de la pupación, la larva entra en un activo
periodo prepupal. Finalmente, el
período pupal dura 3,83 y 3,66 dias para hembras y machos,
respectivamente.
Estudios
realizados por HULL (1995) en Pennsylvania, han descrito que la larva de Stethorus punctum (LeConte) emerge 5
días después de la oviposición, y la duración de los cuatro estadios larvales es
de 12 días aproximadamente.
Finalmente, la larva de cuarto estadio se sujeta firmemente de la hoja y
permanece allí inmóvil por 24 a 48 horas antes de la pupación. La pupa es negra, pequeña y aplanada, la etapa pupal dura un
promedio de 5 días. Posteriormente emerge un adulto el cual en sus primeras horas de vida es
de un color rojo-anaranjado y después va tomando un color negro. El período aproximado desde la
deposición de los huevos a la aparición del adulto es de 23 días y los adultos
se alimentan por un período
promedio de 25 días antes de comenzar a oviponer los
huevos.
Stethorus
histrio Chazeau
se distingue de otras especies de Stethorus del hemisferio Occidental por
la corta e incompleta línea post-coxal, y el vigoroso genital del macho. La única especie que posee similares
caracterísiticas es Stethorus truncatus
Kapur de Malaya (GORDON y ANDERSON, 1979).
2.2.2. Factores que afectan la oviposición
de Stethorus
spp:
En
experimentos realizados por
McMURTRY, SCRIVEN y MALONE (1974) en California, bajo condiciones de
laboratorio; a 21 - 22ºC, cerca del 100% de las hembras de Stethorus picipes Casey presentaron
ovipostura cuando se criaron y mantuvieron hasta adultos, bajo un régimen de 16
horas luz (fotoperíodo). Mientras
que sólo un 30% pudieron oviponer
bajo un régimen de 10 horas de fotoperíodo. Estos autores concluyen que aparentemente a nivel de campo, sólo
una porción de las hembras de una población dada entra en diapausa reproductiva
bajo condiciones de días cortos.
Finalmente, proponen que la diapausa invernal en algunos individuos de S. picipes Casey en el sur de California
permite proteger las especies de temperaturas subcongelantes, las cuales ocurren
ocasionalmente, y también de la escasez de alimento en el otoño e invierno.
Ensayos
a nivel de campo realizados
por PUTMAN (1955) en Ontario, con
especies de Stethorus punctillum
Weise mostraron que los adultos pueden hibernar en varios tipos de sustratos de tierra o casi en el suelo, pero ellos
no sobreviven en los árboles, ya
que son destruidos por las bajas temperaturas.
Otro
factor importante para la
oviposición de las hembras es la presencia y tipo de alimento. En los trabajos realizados por McMURTRY,
SCRIVEN y MALONE (1974) en California, se determinó que fue necesario un exceso
de alimento para inducir un alto grado de oviposición. A cada hembra se le dio
un promedio de 10 mg (equivalente a 3000-5000 huevos y larvas) de arañitas (Tetranychus pacificus McGregor) durante
tres días. En estos ensayos, la oviposición declinó cuando el alimento fue
reducido bajo los 5 mg durante tres días.
Sin embargo, la oviposición se redujo marcadamente cuando las hembras
fueron alimentadas largamente por estados adultos o inmaduros de T. pacificus.
Trabajos
realizados por HOUCK (1991) en condiciones de laboratorio, determinaron que las
hembras de S. punctum expresan una
fuerte preferencia por los huevos de arañita sobre otros estadios de desarrollo
de Tetranychus urticae Koch. Esta consistente elección de la presa
puede ser relacionada a la calidad de ella y a los altos requerimientos de
energía de la hembra para su metabolismo y reproducción, esto debido a que los
huevos de arañitas son ricos en lípidos y proteínas y así pueden satisfacer
mejor sus requerimientos nutricionales.
2.2.3. Conducta y capacidad de depredación
del género de Stethorus
spp:
Tanto
las larvas como los adultos se alimentan de huevos, formas jóvenes y adultos de
tetraníquidos y se ha determinado que los Stethorus adultos eliminan unos 40 de
ellos diariamente, mientras que durante el período de larvas pueden consumir
hasta más de 200 (DORESTE, 1988).
La
larva de S. picipes se alimenta de la
succión del contenido fluido de los huevos y de varios estados activos de Oligonychus punicae y subsecuentemente
regurgita y succiona este contenido sin una ingestión hasta que esté
completamente disuelto (TANIGOSHI y McMURTRY, 1977).
La
larva de S. punctillum se alimenta succionando el
contenido de las arañitas o huevos; el exoesqueleto no es consumido. Una digestión extraoral, en la cual el
contenido intestinal de la larva, tal vez acompañado por secreciones salivales,
son alternativamente regurgitados y succionados fuera de la presa cuando el
contenido del cuerpo se ha disuelto (PUTMAN,1955).
En
ensayos de laboratorio llevados a
cabo por PUTMAN (1955) en Ontario, determinó que hembras de S. punctillum en oviposición comen al día un
promedio de 42,8 arañitas roja europea (Pannonychus ulmi Koch.) ó 40 arañitas
bimaculada (Tetranychus urticae
(Koch)).
De
acuerdo a los estudios de HULL (1995), en Pensilvania, los adultos de Stethorus punctum pueden llegar a consumir 75
a 100 arañitas (Panonychus ulmi) por
día y las larvas pueden devorar sobre 75 arañitas en el mismo lapso; de esta
manera, pueden disminuir rápidamente un ataque violento de estos
ácaros.
Los
estudios realizados por MCMURTRY y JOHNSON (1967) en California, han descrito a
Stethorus picipes Casey como el
depredador más importante de la arañita parda del palto (Oligonychus punicae (Hirst)), sin embargo esta especie
requiere de un gran número de arañitas para su reproducción (un promedio de 10
arañitas por hoja) y no ejercen un
efecto supresivo hasta que la población de ácaros ha alcanzado elevados niveles.
Trabajos
realizados por CONGDON, SHANKS y ANTONELLI (1993) en Washington, se contraponen
a lo anteriormente mencionado, ya que ellos postulan que Stethorus spp. normalmente interactúa
con bajas densidades poblacionales
tanto de depredadores como
de presas. Entonces, la efectividad
de Stethorus spp. como controlador biológico no estaría basada
en una respuesta numérica, sino más bien ser el resultado de mecanismos
conductuales tales como la búsqueda en áreas restringidas, quimiotaxis o ambas.
Estos investigadores estudiaron la interacción entre Stethorus punctum picipes Casey y la
arañita bimaculada (Tetranychus
urticae (Koch)) en Rapsberries; ellos sugieren que cuando las arañitas se
encuentran en bajas densidades poblacionales Stethorus punctum picipes ovipone pocos
huevos, pero los adultos están en la búsqueda de pequeños focos de presas; además, este depredador puede también
subsistir con el rocío dulce de áfidos o exudados de
plantas.
Investigaciones
realizadas por PUTMAN (1955) en laboratorio y también observaciones en el campo, mostraron
que en el primer caso, los adultos
de S. punctillum se alimentaron con
áfidos, en ausencia de arañitas; sin embargo esto no fue observado a nivel de
campo. Adultos de S. punctillum
fueron vistos varias veces en el huerto alimentándose en las secreciones de
las glándulas de duraznero, específicamente de los nectarios
extraflorales.
Según
TANIGOSHI y McMURTRY (1977), en experimentos realizados en laboratorio, en celdillas de aislación, en ausencia
de arañitas, después de 2 a 3 días el segundo y cuarto estado, también los adultos de S. picipes depredaron sobre hembras de
Typhlodromus floridanus
(Muma).
Todos
los estadios de P. persimilis fueron
depredados por S. gilvifrons cuando
se aislaron juntos en jaulas de plexiglass (KAYLANI, 1967, citado por TANIGOSHI
y McMURTRY, 1977).
PUTMAN
(1955) reportó a adultos de S. punctillum
depredando sobre huevos y ninfas de una población mezclada de Typhlodromus spp.
2.2.4. Canibalismo en Stethorus sp.
:
Tendencias
de canibalismo fueron reportadas para la larva de Stethorus bidifus Kapur, S. picipes, y S. punctum LeConte y para todos los estadios activos de S. punctillum Weise. (COTTIER, 1934,
FLESCHNER, 1950, ROBINSON, 1953, y PUTMAN, 1955, citados por TANIGOSHI y
McMURTRY, 1977). Estos
investigadores determinaron, en estudios realizados en laboratorio, que los
adultos de S. picipes no son
canibalísticos con respecto a otros, pero que después de estar unas pocas horas sin otro alimento, los estadios más grandes
se alimentan de los más pequeños. Ellos concluyeron que el canibalismo de Stethorus picipes puede llegar a ser un
importante factor limitante
solamente cuando las arañitas comienzan a escasear.
3. MATERIALES Y
MÉTODOS
3.1.
Materiales:
Se
utilizó un módulo de invernadero ubicado en
las dependencias del Laboratorio de Control Biológico de la Facultad de
Agronomía que corresponde
a un invernadero frío, es decir, está cubierto con plástico y malla rachel
blanca (80%). El invernadero
estaba
dividido en 3 sectores; el primero de 42 m2, el segundo de 21
m2, y el tercero de 21 m2.
En
el primer sector del módulo, se plantaron 55 plantas de crateco (Crataegus sp.).
En
el tercer sector del invernadero, se utilizaron 10 plantas de crateco, en contenedores de 300 ml
aproximadamente, las cuales medían entre 90 a 110 cm de
altura.
En
el segundo sector, se plantaron ocho paltos (Persea americana Mill.) de variedad
Hass. Los paltos fueron confinados
dentro de jaulas de 1m3, de madera, y cubiertas con
muselina.
El
riego en ambos sectores se llevó a cabo a través de un sistema de riego
presurizado (por goteo).
En
las dependencias del Laboratorio de Control Biológico de la Facultad de
Agronomía, se dispuso de una serie de materiales necesarios para la observación,
manipulación y transporte de material entomológico, algunos de ellos fueron los
siguientes: aspirador entomológico, lupa estereoscópica, termómetro de máxima y
mínima, pinzas, pinceles, placas petri, cajas de acrílico transparente Nº 5,
entre otros.
3.2.
Metodología:
3.2.1.
Crianza de Stethorus histrio en
diferentes épocas del año:
En
el primer sector del invernadero, el cual tiene un área de 42 m2, fue
donde se realizó el seguimiento de la población del biocontrolador. En octubre de 1998, se realizó la
plantación de 55 plantas de crateco dispuestas a lo largo de cuatro hileras, con
una distancia de plantación de un metro entre hileras y sobre ellas a
0,3 m.
En
noviembre de 1998, los cratecos fueron inoculados con la arañita roja del palto (Oligonychyus yothersi (Mc Gregor)), la que fue recolectada
de cercos vivos de crateco ubicados en Quillota. La inoculación consistió en dejar sobre
las plantas de crateco hojas infestadas con la arañita. Posteriormente, se realizó una nueva
inoculación, debido a que la población de arañitas dentro del invernadero aún
era baja. En diciembre del mismo año, se inoculó la
primera planta de la primera hilera, con cuatro adultos de Stethorus histrio. Después de dos días, se monitorearon las
plantas constatando que los adultos se habían establecido y se estaban
alimentando de las arañitas. Por lo
tanto, ese mismo día se procedió a inocular el resto de las hileras con más
arañitas.
A partir de mayo de 1999, se
recolectaron y mantuvieron dentro de cajas de acrílico (dentro del invernadero)
todas las hojas con pupas dos veces por semana, para poder realizar una
estimación cuantitativa de la población de este biocontrolador. Sin embargo, esta metodología se utilizó
sólo hasta el mes de septiembre, debido a la elevada mortalidad de pupas y a una
considerable declinación en las poblaciónes del biocontrolador y de las
arañitas.
Debido
a que en el mes de diciembre de 1999, la población de Oligonychus yothersi y de Stethorus histrio comenzó a aumentar
nuevamente, se procedió a realizar
una estimación cuantitativa cada dos semanas de esta población, mediante el uso
de un aspirador entomológico para la extracción de los insectos. Después de aspirar y contabilizar a
todos los adultos existentes en las plantas, sólo se incorporó al invernadero un
20% de ellos (para continuar la reproducción), y el resto fue liberado en
terreno.
3.2.2.
Determinación del ciclo de vida de Stethorus histrio
Chazeau:
Debido
a que no existen antecedentes sobre la duración de los diferentes estadios de Stethorus histrio en condiciones de
campo, se realizó el seguimiento de su ciclo de vida dentro del sector uno del
invernadero.
Durante
los meses de julio, agosto e inicios de septiembre, fueron confinados por 24
horas, adultos de Stethorus histrio
junto con hojas de crateco, infestadas con la arañita roja del palto en cajas
transparentes de acrílico Nº 5.
Dentro de la parte inferior de estas cajas, se depositó algodón
humedecido para mantener una constante y adecuada humedad, y en la parte
superior, se cubrió con muselina para permitir la ventilación. Después de transcurrido un día, los
adultos fueron removidos de las cajas y posteriormente se revisaron
minuciosamente las hojas (con la lupa), para buscar los huevos ovipuestos por
las hembras adultas. Los huevos
encontrados fueron aislados en cajas individuales (de acrílico Nº 5) y
mantenidos dentro del invernadero (en las condiciones antes mencionadas), donde
fueron monitoreados diariamente hasta el momento de la eclosión. Una vez emergida la larva, se le
añadieron diariamente hojas de crateco infestadas con adultos y huevos de
arañita, realizando un seguimiento de la duración de todos los estadios del
depredador desde la etapa de huevo hasta adulto.
Debido
a la alta mortalidad producida, se decidió seguir con el estudio del ciclo
biológico de Stethorus en plantas
jóvenes de crateco, evitando al máximo la manipulación de los insectos. Los ensayos no pudieron ser reanudados
hasta la segunda quincena de diciembre, dada la
escasez de las arañitas y también de Stethorus, producida tanto dentro del
invernadero como en terreno. En
esta fecha, se compraron diez plantas de crateco en contenedores de 300 cc, las
cuales durante 17 días fueron inoculadas diariamente con hojas de esta planta y
de palto, infestadas con la arañita roja del palto (Oligonychus yothersi (McGregor.)). Posteriormente, se inocularon
individualmente con 3 adultos de Stethorus histrio, durante 24 horas.
Para evitar que los adultos volaran o se posaran en otra planta de crateco,
éstas fueron cubiertas con mangas de muselina. Luego, los adultos fueron cuidadosamente
extraídos y se revisaron las plantas (con el uso de una lupa manual, de aumento
8X), marcando las hojas en las que
se encontraron huevos. Se realizó un seguimiento diario de éstos hasta el
momento de la eclosión, en donde se decidió dejar sólo una larva por planta.
Finalmente, se continuó monitoreando diariamente las larvas y pupas, para
completar el seguimiento de su ciclo biológico.
3.2.3.
Efecto de Stethorus histrio sobre
la población de la arañita roja del palto:
Esta
actividad se realizó en el segundo sector dentro del invernadero, el cual es más
pequeño que el primero, posee un área de 21 m2, y en él se plantaron
los paltos de variedad Hass, los que estaban confinados dentro de las “jaulas de
muselina”.
Los paltos fueron
plantados a fines del mes de marzo de 1999 en dos hileras (4 plantas por
hilera), con un marco de plantación de 1 m2. A fines de mayo, las dos hileras de
paltos fueron inoculadas con la arañita roja del palto (Oligonychus yothersi (McGregor)). Desde su inoculación se realizó un
monitoreo semanal de la población de las arañitas, con el uso de una lupa manual
(aumento 8X) y se cuantificó el aumento de esta población en las distintas
épocas del año. En cada planta de
palto, se eligieron dos hojas al azar (sin extraerlas), y en ellas se cuantificó
mediante recuento el número de estadios móviles y el número de huevos cada
semana.
Los adultos de Stethorus histrio fueron inoculados el 12 de diciembre. Se compararon las poblaciones de
arañitas de las plantas con y sin depredadores, a modo de determinar su
incidencia en la reducción de la plaga.
Los datos obtenidos fueron analizados a través de un diseño completamente
aleatorio (DCA), en el cual la unidad de muestreo fue número de arañitas por 4
cm2 de área foliar y número de huevos por 4 cm2 de área
foliar. Se utilizó el test "Mann-Whitney" para la comparación de
medias.
Todos los ensayos
antes mencionados, llevaron un registro diario de la temperatura máxima y mínima
dentro del invernadero (Anexo 4 al 13).
4. PRESENTACIÓN Y DISCUSIÓN DE
RESULTADOS
4.1. Crianza de Stethorus histrio en diferentes épocas
del año:
Durante
el mes de marzo de 1999, se observó una disminución en la población de arañitas
y Stethorus en las plantas de
crateco. En la última semana de
marzo, se realizaron monitoreos para poder obtener una estimación del número de
adultos, por lo cual se recorrieron
las cuatro hileras de crateco contabilizando los ejemplares encontrados. El número promedio de adultos de Stethorus histrio encontrados en ese
período dentro del invernadero fue de cuatro.
Los
resultados obtenidos mediante la recolección semanal de hojas de crateco con
pupas de Stethorus histrio, entre los
meses de mayo a agosto, y parte del mes de septiembre, fueron expresados como
número de pupas recolectadas, número de adultos emergidos, y porcentaje de
emergencia y mortalidad (Anexo 1).
La recolección se realizó con el estadio de pupa y no el adulto, debido a
que es más fácil su manipulación y permite tener una estimación de la actividad
reproductiva de la población.
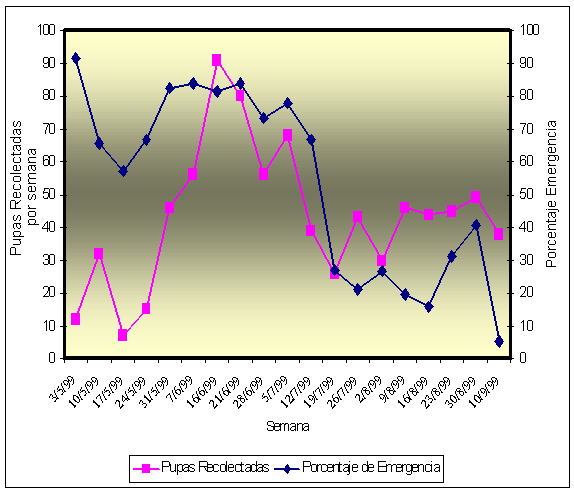
FIGURA
1. Porcentaje de emergencia de
adultos de Stethorus histrio
Chazeau,
desde pupas recolectadas en el invernadero.
La
población de Stethorus histrio se
mantuvo presente durante los meses en los cuales se llevó a cabo la recolección
de las pupas (Figura 1); sobrevivieron alimentándose de las arañitas y,
además, pudieron reproducirse. Entre los meses de mayo a junio, la
recolección de pupas aumentó gradualmente, siendo el mes de junio el período en
donde se encontró el mayor número de pupas por recolección (en la semana del 14
y 21 de junio con 91 y 80 pupas, respectivamente, (Anexo 1)). Durante estos
meses, la población de arañitas se mantuvo en contínuo aumento, observándose en
las hojas de las plantas de crateco un fuerte bronceamiento, incluso se pudo
percibir una parcial defoliación en algunas ramillas. El
porcentaje de emergencia de adultos de Stethorus histrio en la primera semana
de mayo fue elevado (91,6%), sin embargo, disminuye notoriamente durante las
siguientes tres semanas. A comienzos de junio, comienza a
aumentar nuevamente el porcentaje de emergencia de adultos, y esta tendencia se
mantiene durante todo el mes. A
inicios del mes de julio, tanto el
número de pupas recolectadas como el porcentaje de emergencia de adultos de Stethorus comienza a disminuir
gradualmente, hasta la tercera semana, donde se produce una brusca caída
especialmente en el porcentaje de emergencia de adultos. La permanencia y aumento de la población
de Stethorus histrio, se debió a que
la población de las arañitas se mantuvo alta durante los meses de mayo a junio,
corroborando lo afirmado por ROJAS (1981), el cual afirma que los ataques de
este ácaro van en aumento desde el verano al otoño, e inclusive invierno. Por otra parte, de acuerdo con lo
afirmado por LÓPEZ (1997), las altas temperaturas de finales de verano, otoño, e
incluso principios de invierno, favorecieron la actividad diaria y la velocidad
con que se multiplican los ácaros, explicando así la abundancia de esta
plaga.
El
aumento de Stethorus en los meses en
los cuales las arañitas alcanzaron los mayores niveles poblacionales (cuando se
presentó el mayor bronceamiento y parcial defoliación en las plantas de
crateco), confirma las observaciones de McMURTRY y JOHNSON (1966), en donde se
reconoce que las especies de Stethorus
requieren densidades relativamente altas de sus presas, para iniciar su
reproducción. Además, McMURTRY,
SCRIVEN y MALONE (1974), y HOUCK (1991) indican la preferencia de las hembras
adultas de la especie de Stethorus picipes por los huevos de la
arañita, para inducir la oviposición.
Una
disminución en el número de pupas recolectadas, y en el porcentaje de
emergencia, se comenzó a observar a partir de la segunda quincena de julio,
siendo muy marcada en agosto y septiembre.
Si bien, durante ese período la recolección de pupas continuó (aunque en
una menor cantidad), el porcentaje de emergencia siguió disminuyendo
rápidamente, registrándose en la última semana de septiembre el valor más bajo:
un 2%. Con respecto a este último
aspecto, la gran deshidratación de las hojas de crateco (producto del alto grado
de bronceamiento que presentaban las plantas), pudo haber afectado
significativamente la viabilidad de las pupas, por lo que no se continuó
utilizando el sistema de recolección de pupas, como metodología para cuantificar
(como estimado) la reproducción del biocontrolador.
La
disminución en el número de pupas de Stethorus histrio recolectadas, pudo
haber sido el resultado de la influencia de factores abióticos (temperatura,
humedad, precipitaciones, entre otros), y bióticos. Con relación a los factores abióticos,
durante los meses de junio a septiembre, se observó un descenso de las
temperaturas (Anexo 10, 11, 12 y 13), registrándose temperaturas mínimas que
alcanzaron los 1.8 ºC bajo cero en el invernadero durante el mes de Julio. El descenso de las temperaturas durante
el transcurso del otoño e invierno, es un factor que afecta a las arañitas. VERA (1994) reportó la existencia de
diferencias en la duración del ciclo biológico de Oligonychus yothersi McGregor, a través
del año, lo que significa que durante los meses invernales se genera un menor
número de poblaciones de estos ácaros.
Por otro lado, la presencia de precipitaciones en los meses de agosto y
septiembre, incidieron en el aumento de la humedad relativa del ambiente, y de
acuerdo con lo indicado por DORESTE (1988), es detrimental para las arañitas
favoreciendo la muerte de ellas en las mudas. La influencia de los factores climáticos
durante los meses de junio a septiembre, produjo una disminución en la población
de las arañitas, afectando como consecuencia la población del
biocontrolador. Cabe destacar que
las condiciones invernales (bajas temperaturas y fotoperíodo de día corto, entre
otros), también pudieron haber afectado la capacidad reproductiva de las hembras
adultas de Stethorus histrio, tal
como lo afirmaron McMURTRY, SCRIVEN y MALONE (1974), induciendo parte de ellas a
una diapausa reproductiva, que les permitiría protegerse de las bajas
temperaturas y de la escasez de alimento.
Los
factores bióticos que posiblemente influyeron en la disminución del número
de pupas recolectadas fueron
competencia intraespecífica dentro de la población de Oligonychus yothersi, y la eficiente
capacidad depredadora de Stethorus
histrio. Con relación al primer
factor, éste no fue evaluado en terreno pero existen antecedentes de McMURTRY y
JOHNSON (1966), en lo cuales las investigaciones realizadas a nivel de campo en
el sur de California, demostraron que cuando la población de una especie
similar, Oligonychus punicae (Hirst.)
alcanza elevadas densidades, produciendo un gran bronceamiento en las hojas,
éstas finalmente se autorregulan si la población no es controlada por otros
factores. Esto se debe a que las
áreas bronceadas (causadas por una excesiva alimentación por parte de las
arañitas), no les permite continuar con las condiciones favorables para la
reproducción y alimentación de ellas mismas.
La
capacidad depredadora de Stethorus
histrio, junto a los factores
mencionados, influyeron en la disminución en los niveles de las
arañitas. Por otro lado, a partir
de agosto, las plantas de crateco comenzaron a desarrollar brotes nuevos, y
durante los meses de septiembre, octubre y noviembre, las hojas de las plantas
se mantuvieron verdes, sin ningún grado de bronceamiento, lo cual indicaba un
bajo nivel poblacional de arañitas.
Debido
al descenso en la población de Oligonychus yothersi se realizaron desde
octubre hasta diciembre nuevas inoculaciones con hojas infestadas con la arañita roja del
palto.
A
partir del mes de octubre, se comenzó a estimar la población adulta de Stethorus histrio a través de un
"recuento" cada 15 a 20 días aproximadamente (mediante el uso de un aspirador
entomológico), incorporando al invernadero sólo el 20% para poder continuar con
su reproducción. Los datos fueron
expresados como número de adultos de Stethorus histrio, y se resumen en el
Anexo 2.
La
población de adultos de Stethorus
histrio, se mantuvo baja (Figura 2) durante los meses de octubre,
noviembre, e inicios de diciembre, lo cual coincidió con la baja población de
arañitas, que sólo comenzó aumentar a partir de diciembre. En este mes, la población adulta del
biocontrolador comienza a aumentar de igual forma que su presa. Sin embargo, la cantidad de adultos
extraídos en todo el invernadero (de 42 m2) es bastante baja, en
relación al tamaño de las plantas de crateco, y a la superficie del
invernadero. Esta baja cantidad
extraída, en relación a la superficie del invernadero y al volumen (foliar) de
las plantas de crateco, puede estar más relacionada con el crecimiento en la
población de la arañita. Si bien en
diciembre comienza a aumentar la población de este ácaro, aún no se encuentra en
su máximo nivel.
Cabe
destacar que estos datos son sólo una estimación, dado que las plantas de
crateco poseían un crecimiento libre, sólo se realizaban podas para mantener los
pasillos del invernadero despejado para poder transitar libremente. Por lo tanto, pudieron existir adultos
que no fueron contabilizados y que se encontraban en el follaje interno de la
planta, al cual no se tenía acceso.

FIGURA
2. Número de adultos de Stethorus histrio Chazeau,
contabilizados
durante los meses de octubre, noviembre, diciembre y enero de
1999 - 2000.
4.2. Determinación del ciclo de vida de Stethorus
histrio:
Durante
los meses de julio y agosto, se realizaron ocho ensayos para poder determinar la
duración de los diferentes estadios del ciclo de vida de Stethorus histrio dentro del
invernadero; sin embargo, ninguno de ellos tuvo resultados positivos,
presentándose una elevada mortalidad.
Se aislaron en total 45 huevos de Stethorus, sin embargo la mortalidad fue
de un 100%, distribuyéndose en un 71.1% de huevos, y el 100% de las larvas
eclosionadas de los huevos (Cuadro 1).
CUADRO
1. Porcentaje de mortalidad de huevos y larvas de Stethorus histrio
Chazeau, durante el seguimiento del ciclo biológico dentro del
invernadero, en los meses de julio y agosto de
1999.
|
Estadio |
Número
Inicial |
Nº
Eclosionados |
No
Eclosionados |
Mortalidad
(%) |
|
Huevos |
45 |
13 |
32 |
71.11 |
|
Larvas |
13 |
0 |
0 |
100 |
Esta
elevada mortalidad pudo haber estado relacionada con la metodología
utilizada. Por una parte, la
mortalidad de huevos debe haber sido una consecuencia de la manipulación a la
cual estuvieron expuestos (al extraerlos y colocarlos en hojas de crateco
aisladas), produciéndole daño en el corión. Por otro lado, pudo haber existido una
excesiva deshidratación de estos huevos al estar depositados sobre las hojas de
crateco sueltas en el interior de las
cajas de acrílico. Estas hojas
presentaban un aspecto bastante deterioradas, debido al bronceamiento ocasionado
por la alta infestación con arañitas.
La normal deshidratación que estas hojas sueltas sufren en el transcurso
de los días, y la mala condición de la hoja por el bronceamiento, pudo haber
afectado (disminuido) la viabilidad de los huevos.
Con
respecto a las larvas, su mortalidad
pudo haber estado relacionada a
malas condiciones de humedad y de temperatura generadas dentro de las cajas de acrílico a las cuales fueron
confinadas. A pesar de poseer en la
cubierta superior una malla de muselina, que permitiera una adecuada
ventilación, esta pudo haber sido insuficiente, especialmente en las horas de
mayor temperatura en el día. Con respecto a la humedad, en forma periódica se
mantenían pequeños trozos de algodón humedecido dentro de las cajas, de manera
de mantener un cierto grado de humedad dentro de ellas. Sin embargo, esta medida pudo haber sido
insuficiente, produciendo un ambiente muy seco que afectó la viabilidad de la
larva.
De
los 45 huevos aislados, sólo 13 eclosaron, y aunque las larvas murieron, se
pudieron obtener datos estimativos del período de incubación de estos huevos
(Cuadro 2). El período de
incubación tuvo una duración
promedio de 11,6 días para los 13 huevos que eclosaron durante los meses de
julio y agosto, bajo condiciones de temperatura promedios mínima y máxima de 2.4
y 34.2 ºC, respectivamente (Anexos 11 y 12).
De
acuerdo a los resultados anteriores, se determinó realizar nuevos seguimientos
del ciclo biológico de Stethorus
sobre diez plantas de crateco en contenedores, con los objetivos de reducir al
máximo la manipulación de los insectos, no alterar las condiciones ambientales
(temperatura, humedad y luminosidad, entre otras), ni la disponibilidad de las
arañitas, de manera que todos estos factores se asemejaran a los existentes en
condiciones de campo. Estos ensayos
se pudieron realizar a partir del mes de diciembre de 1999, período en el cual
comenzó a aumentar la población de Oligonychus yothersi y de Stethorus histrio. Una vez que las plantas de crateco
estuvieron bastante infestadas con la arañita, se inocularon con adultos de Stethorus para inducir el apareamiento y
la oviposición de las hembras adultas.
CUADRO 2. Duración del período de incubación
de huevos de Stethorus histrio
Chazeau,
realizado dentro del invernadero durante los meses de julio y agosto de
1999.
|
Huevo |
Período
de incubación (días) |
|
1 |
9 |
|
2 |
12 |
|
3 |
11 |
|
4 |
10 |
|
5 |
12 |
|
6 |
12 |
|
7 |
12 |
|
8 |
12 |
|
9 |
12 |
|
10 |
7 |
|
11 |
12 |
|
12 |
12 |
|
13 |
13 |
|
Promedio |
11,6 |
|
Rango. |
7
- 13 |
El
ciclo biológico de Stethorus histrio
Chazeau bajo condiciones de invernadero, en el mes de enero, mostró una
duración promedio de 20,6 días (Cuadro 3). La duración promedio del período de
incubación de los huevos (desde su ovipostura, hasta la eclosión) fue de 6,5
días, similar a la obtenida por VERA (1994) en condiciones de laboratorio (a una
temperatura promedio de 23ºC,y un período de luz oscuridad de 12 horas). Con respecto al período larval y de
pupación, la duración promedio de ellos fue de 9,7, y 4,4 días, respectivamente.
CUADRO
3. Duración del Ciclo Biológico de
Stethorus histrio Chazeau,
durante
el mes de enero del 2000.
|
Huevo
Nº |
Eclosión
(días) |
Período
larval (días) |
Período
de pupación (días) |
Total
(días) |
|
1 |
6 |
10 |
4 |
20 |
|
2 |
5 |
9 |
4 |
18 |
|
3 |
7 |
11 |
4 |
22 |
|
4 |
7 |
10 |
4 |
21 |
|
5 |
6 |
10 |
4 |
20 |
|
6 |
7 |
10 |
4 |
21 |
|
7 |
7 |
10 |
5 |
22 |
|
8 |
6 |
10 |
4 |
20 |
|
9 |
7 |
9 |
6 |
22 |
|
10 |
7 |
8 |
5 |
20 |
|
Promedio |
6,5 |
9,7 |
4,4 |
20,6 |
|
Rango |
5
- 7 |
8
- 11 |
4
- 6 |
18
- 22 |
El
período de eclosión de los huevos de Stethorus histrio en invierno (once
días) fue casi el doble, con respecto al período de eclosión en verano (seis
días), lo cual pudo haber estado
relacionado con las condiciones climáticas (de temperatura, humedad,
luminosidad, entre otras.) de cada época. Con respecto a las temperaturas
mínimas promedio en el invernadero en invierno fueron 2.8ºC (julio), 2.4ºC
(agosto) y en verano 2.9ºC (diciembre), 2.4ºC (enero). Las temperaturas máximas promedio en el
invernadero en invierno fueron 31.6ºC (julio), 34.6ºC (agosto) y en verano 36ºC
(diciembre), 36.2ºC (enero). Y las
temperaturas medias promedio en el invernadero fueron de 17.2ºC (julio), 18.4ºC
(agosto) y en verano 19.4ºC (diciembre), 19.3ºC (enero). Los registros de temperatura dentro del
invernadero en los meses de mayo a febrero (Anexos 9 al 18), muestran diferencias entre las mínimas promedio
en los meses registrados, al igual que con las máximas promedio. Esto corrobora lo afirmado por LÓPEZ (1997), quien
señala cómo la temperatura influye en la velocidad de reproducción de los
insectos y en su actividad diaria.
4.3.
Efecto de Stethorus histrio sobre
la población de la arañita roja del palto:
Para poder determinar el efecto de Stethorus histrio sobre la población de
Oligonychus yothersi, a finales del
mes de mayo, se comenzó a realizar un seguimiento de la población de Oligonychus yothersi (McGregor),
contabilizando cada siete días el número de estadíos móviles y el número de
huevos dentro de un cuadrante de 4 cm2 de área foliar, en los
ocho paltos "Hass" plantadas en el
sector dos del invernadero.
Los
datos sobre la evolución de la población de la arañita roja del palto, en las plantas, durante los meses de mayo a
diciembre fueron expresados como
número de estadios móviles en 4 cm2 de área foliar y número de huevos
de arañitas en 4 cm2 de área foliar ( Anexo 5 y 6). Los niveles de la población de las
arañitas presenta varios peak de crecimiento a lo largo del año en cada planta,
los datos fueron resumidos como número promedio de estadios móviles y de huevos
en los ocho paltos, durante ese período (Anexos 3 y 4, Figura 3 y 4). Esto
corrobora lo observado por McMURTRY y JOHNSON (1966), donde señala la gran
variabilidad en los niveles
poblacionales que alcanza el
género Oligonychus cada año y en
diferentes lugares. Sin embargo, se puede apreciar una tendencia general, en la
cual, entre los meses de julio y de septiembre se producen los mayores niveles
de esta arañita dentro del invernadero (Figura 3 y 4), para después ir
declinando en octubre, llegando a disminuir casi por por completo en el mes de
noviembre. Es conveniente destacar
que este comportamiento se dio dentro del invernadero, ya que a nivel de campo
la arañita roja del palto presenta sus mayores niveles poblacionales en el
verano y otoño (LOPEZ, 2000)*. El
aumento de la arañita roja del palto hacia fines de invierno y principios de
primavera en condiciones de invernadero, sería un aspecto favorable en la crianza de Stethorus histrio en este período.*
A
finales de septiembre, comenzó a producirse un crecimiento vegetativo en las
plantas de palto, por lo tanto, las hojas viejas fueron decayendo y comenzaron a
desarrollarse nuevos brotes vegetativos. El descenso en la población de arañitas
(Figuras 3 y 4) se pudo deber a que se
habrían autorregulado ellas mismas (competencia intraespecífica) ante la
falta de hojas maduras en las cuales seguir alimentándose y reproduciéndose (ya
que algunas hojas viejas cayeron,
incluso antes que se desarrollaran los nuevos brotes). De acuerdo con los
antecedentes recopilados por McMURTRY y JOHNSON (1966), la condición de la hoja
hospedera es un factor clave que afecta el potencial reproductivo de esta
arañita, ya que las hojas viejas con un gran porcentaje de su área bronceada
(causadas por una excesiva alimentación por parte de las arañitas), no son
favorables para continuar con la
reproducción y alimentación de ellas mismas. Además, las arañitas no colonizaron las
hojas nuevas hasta que estas se endurecieron y adquirieron un color verde más
oscuro, lo cual también afirma lo descrito por este investigador.
A finales del mes de agosto, comenzó a
aparecer en las plantas de palto, otro insecto, que también es un controlador de
Oligonychus yothersi, se trata de un
Coleóptero, de la familia Staphylinidae Oligota pygmaea Solier. Este biocontrolador al igual que Stethorus consume, tanto la larva como
el adulto, todos los estadios de la
arañita. Para evitar que este depredador continuara disminuyendo los niveles
poblacionales de la arañita, se procedió a monitorear las plantas semanalmente,
extrayendo (por aspiración) todos los adultos y larvas encontrados en las
plantas de palto. La presencia de este biocontrolador continuó durante todo
octubre hasta finales de noviembre, a pesar de que periódicamente eran extraídos
de las plantas. Este es otro factor
a considerar, en el lento aumento de la población de Oligonychus en las plantas de
palto.
Como
consecuencia de la declinación de la población de las arañitas, a partir del mes
de septiembre, se retrasó la inoculación con adultos de Stethorus histrio (a la mitad de las
plantas de paltos), realizándose en el mes de enero, época en la cual los
niveles poblacionales de la arañita, comenzaron a aumentar nuevamente.

FIGURA 3.
Número de estadios móviles de Oligonychus yothersi McGregor,
en
las ocho plantas de palto Hass, en los meses de mayo a diciembre de
1999.(Promedio)
FIGURA
4. Número de huevos de Oligonychus yothersi McGregor en las
ocho

plantas
de palto Hass, en los meses de mayo a diciembre de 1999.
(Promedio)
El 12 de enero del 2000, la mitad de las
plantas de palto fueron inoculadas individualmente con cuatro adultos de Stethorus histrio Chazeau (Grupo 1), y
la otra mitad permaneció como grupo control (Grupo 2). Las mediciones se
realizaron durante cinco semanas consecutivas, desde el 12 de Enero hasta el 9
de Febrero del 2000. Los datos fueron agrupados por planta, hoja, grupo y por semana de medición,
siendo denominada semana cero aquella en que realizó la inoculación (Cuadro
4).
CUADRO
4. Cuantificación de los
estadios móviles y de huevos de Oligonychus
yothersi
(McGregor.) entre el grupo uno (control) y el grupo dos
(con Stethorus) durante los meses de enero y
febrero del 2000.
|
|
Semana
de Medición | |||||||||||
|
Estadios
Móviles |
Huevo | |||||||||||
|
Grupo |
Planta |
Hoja |
I0 |
I1 |
I2 |
I3 |
I4 |
H0 |
H1 |
H2 |
H3 |
H4 |
|
1 |
4 |
1 |
6 |
8 |
4 |
4 |
9 |
4 |
10 |
0 |
7 |
7 |
|
4 |
2 |
3 |
4 |
2 |
4 |
10 |
6 |
7 |
6 |
8 |
12 | |
|
5 |
1 |
5 |
4 |
8 |
6 |
5 |
4 |
6 |
5 |
11 |
11 | |
|
5 |
2 |
4 |
4 |
6 |
14 |
9 |
2 |
6 |
10 |
8 |
7 | |
|
6 |
1 |
9 |
6 |
10 |
8 |
21 |
12 |
10 |
15 |
7 |
18 | |
|
6 |
2 |
5 |
8 |
8 |
5 |
17 |
9 |
11 |
10 |
4 |
15 | |
|
8 |
1 |
4 |
6 |
8 |
11 |
14 |
2 |
9 |
14 |
12 |
21 | |
|
8 |
2 |
9 |
7 |
8 |
6 |
11 |
12 |
11 |
10 |
16 |
12 | |
|
2 |
1 |
1 |
10 |
5 |
4 |
9 |
10 |
22 |
12 |
0 |
7 |
12 |
|
1 |
2 |
5 |
3 |
5 |
7 |
11 |
10 |
4 |
8 |
11 |
20 | |
|
2 |
1 |
18 |
5 |
4 |
3 |
0 |
20 |
4 |
3 |
4 |
0 | |
|
2 |
2 |
6 |
8 |
8 |
1 |
0 |
18 |
12 |
2 |
0 |
0 | |
|
3 |
1 |
6 |
9 |
4 |
1 |
0 |
11 |
14 |
0 |
2 |
0 | |
|
3 |
2 |
5 |
7 |
3 |
0 |
0 |
9 |
11 |
2 |
0 |
0 | |
|
7 |
1 |
7 |
4 |
12 |
7 |
6 |
10 |
2 |
16 |
8 |
15 | |
|
7 |
2 |
10 |
4 |
9 |
5 |
5 |
6 |
6 |
11 |
7 |
13 | |
Se
analizó el efecto de Stethorus
histrio sobre los estadios móviles y los huevos de Oligonychus yothersi, utilizando el test
de Mann-Whitney, para la comparación de medias entre el control o Grupo 1 y el tratamiento con
el depredador o Grupo 2 (Anexos 7 y 8 y Figura 5 y 6), y utilizando
correlaciones lineales para establecer la forma en que evolucionaron las
densidades de arañitas y huevos durante las cinco semanas.
Se
pudo apreciar (Figura 5) que la población de Oligonychus yothersi, en el grupo 2 (con
Stethorus), comenzó las mediciones
con un número promedio de estadios móviles más alto que el grupo control. Sin
embargo, cabe destacar, que a la
segunda semana se cruzan las densidades,
a pesar de que el grupo dos (con Stethorus) había comenzado con una
mayor densidad poblacional, luego
éstas continúan siendo cada vez menores. Durante las cuatro primeras semanas de
mediciones, no hubo diferencias significativas entre número promedio de estadios
móviles para ambos grupos, a pesar que en la cuarta semana de medición se
aprecia una disminución para el grupo con el depredador, (de 6,13 a 4,14), esta
no fue estadísticamente
significativa. Sólo en la quinta y
última semana de medición, el
número promedio de estadios móviles de arañitas, en el grupo 2 fue
significativamente menor (p= 0,02) que con respecto al grupo 1 o control (Anexo
7 y Figura 5).
Con
respecto a las mediciones de los huevos de Oligonychus yothersi, durante la primera
semana de mediciones, se aprecian ya diferencias significativas entre el grupo
control y el depredador (p= 0,03), lo cual
podría deberse al hecho de que la infestación inicial con las arañitas
fue mucho mayor en las plantas con depredador que en el grupo control. Al igual
que en el caso anterior, en el grupo control, comienza a aumentar el número
promedio de huevos y a disminuir en el grupo con el depredador llegando a ser
sus medias significativamente menores en la cuarta semana (p= 0,05). Al transcurrir la última semana de
medición, hay un aumento en el número promedio de huevos en el grupo con el
depredador, aunque ésta no fue significativa, y con respecto al grupo control,
éste continuó con una tendencia creciente a aumentar el número de éstos (Anexo 8
y Figura 6).
En
general, las tendencias seguidas por las densidades poblacionales tanto de
estadios móviles de la arañita como de sus huevos, es de disminuir desde la semana cero a la cuarta para el grupo
con el depredador (Stethorus) y de
aumentar para el grupo control (Figuras 5 y 6). Estas tendencias son estadísticamente
significativas en todos los casos con p menores a 0,05.

FIGURA
5. Densidad semanal de estadios
móviles de Oligonychus yothersi
McGregor., en 4 cm2 de área foliar, en paltos Hass con y sin
Stethorus histrio Chazeau,
durante enero y febrero del 2000.

FIGURA
6. Densidad semanal de huevos de Oligonychus yothersi McGregor.,
en 4 cm2 de área foliar, en paltos Hass con y sin Stethorus histrio
Chazeau, durante enero y febrero
del 2000.
5. CONCLUSIONES
q
Es
posible realizar una crianza de Stethorus
histrio Chazeau, en invernadero frío, a lo largo del año, en Quillota.
q
En
condiciones de confinamiento, se logró determinar el ciclo biológico completo de
Stethorus histrio en verano. Durante la época invernal, sólo fue
posible determinar el período de
incubación de huevos de Stethorus
histrio.
q
En
condiciones de confinamiento, el ciclo biológico de Stethorus histrio, fue influido por las
condiciones ambientales, con ciclos biológicos menores en
verano.
q
Stethorus
histrio
Chazeau, tiene un efecto supresor sobre los estadios móviles y los huevos de Oligonychus yothersi (McGregor),
llegando a disminuir significativamente los niveles poblacionales de esta
especie de ácaro, durante los meses de verano.
6. RESUMEN
Una
de las principales plagas del palto en nuestro país es la arañita roja del palto
(Oligonychus yothersi
(McGregor.). Debido a que gran
parte del área en donde se realiza el cultivo de este frutal corresponden a
cerros, el método de control biológico se presenta como una alternativa viable
para mantener la densidad poblacional de plaga bajo el umbral de daño
económico. Destaca entre los
enemigos naturales de este ácaro, el coleóptero coccinélido Stethorus histrio Chazeau, el cual es un
voraz depredador de todos los estadios de la arañita. Sin embargo, este
biocontrolador aparece tarde en la temporada, cuando las poblaciones de las
arañitas son muy elevadas, y ya han causado daño al cultivo. Mediante un sistema de crianza masiva,
este depredador podría ser liberado masivamente temprano en la temporada, de
manera de poder realizar un eficiente control sobre esta plaga. El desconocimento de antecedentes sobre
la crianza masiva de Stethorus
histrio, ha motivado esta investigación, con el fin de establecer un módulo
de crianza.
El
primer objetivo planteado fue determinar la factibilidad técnica de crianza de
Stethorus histrio Chazeau, en
diferentes épocas del año, bajo condiciones de invernadero frío. Los resultados obtenidos a través de la
extracción de las hojas con pupas
(mantenidas dentro del invernadero) mostraron que la actividad reproductiva de
Stethorus depende fuertemente de la
abundancia de Oligonychus yothersi,
presentándose durante los meses de mayo a junio la mayor actividad reproductiva
del biocontrolador, que coincidió con un alto nivel en la población de la
arañita. Luego, la actividad
reproductiva de Stethorus histrio,
comienza nuevamente a aumentar a partir de diciembre, simultáneamente con la
población de Oligonychus. Es posible
realizar una crianza de Stethorus
histrio, a lo largo del año, bajo condiciones de invernadero frío, pero se
deben tener presente una serie de limitantes, como son las condiciones
climáticas (temperatura, humedad, fotoperíodo, entre otras), el manejo de la
planta hospedera y la plaga.
El
segundo objetivo fue determinar la duración de todos los estadios del ciclo de
vida de Stethorus histrio en condiciones de crianza. A lo largo del año, sólo se pudo
determinar la duración del período de incubación de huevos de Stethorus, siendo en la época invernal
casi el doble (once días), con respecto al verano (seis días). Esta diferencia se debió,
principalmente, a la influencia de las condiciones climáticas de cada estación,
especialmente referido a la temperatura, la cual determina entre otras cosas la
velocidad de reproducción de los insectos.
No se pudieron obtener más datos del ciclo de vida, en invierno, debido
a la metodología utilizada
inicialmente, la que consistió en
mantener a los huevos y larvas dentro de cajas de acrílico transparente
dentro del invernadero, lo que se tradujo en una excesiva manipulación
principalmente de los huevos, afectando de esta forma su viabilidad y
la de las larvas. En enero,
se realizó un un nuevo seguimiento ciclo biológico de Stethorus histrio Chazeau, pero en
plantas de crateco en contenedores.
Los resultados demostraron que el ciclo de vida de este insecto en
verano tiene una duración promedio
de 20,6 días, la duración promedio del período de incubación de huevos, de la
etapa larval y de pupación fue 6,5 días, 9,7 días y 4,4 días,
respectivamente.
Finalmente,
el tercer objetivo de este trabajo fue determinar el efecto de Stethorus histrio sobre la población de
la arañita roja del palto, a través de una cuantificación de los estadios
móviles y de huevos de esta plaga sobre plantas de palto Hass. Los resultados obtenidos mostraron que
este biocontrolador tiene un efecto supresor sobre los estadios móviles y los
huevos de Oligonychus yothersi
(McGregor), llegando a disminuir significativamente los niveles poblacionales de
este ácaro durante los meses de verano.
6. LITERATURA CITADA
ANDERSON,
D. M., and GORDON, R. D. 1979. The genus Stethorus Weise
(Coleóptera: Coccinellidae) in Chile. The Coleopterists
Bulletin
33(1): 61-67.
CONGDON,
B. D., SHANKS, J. R., and
ANTONELLI, A. L.
1993.
Population
interaction
between Stethorus punctum picipes
(Coleoptera: Coccinellidae) and Tetranychus urticae (Acari:
Tetranychidae) in Red Raspberries at low predator prey densities. Environmental
Entomology 22(6): 1302-1307.
DORESTE,
E. 1988. Acarología. 2ª Ed. San José. IICA. 410p.
GONZÁLEZ,
R. 1961. Contribución al conocimiento de los
ácaros del manzano
en
Chile Central. Santiago,
Universidad de Chile, Facultad de Agronomía. 58p (Boletín Técnico Nº
11).
GONZÁLEZ,
R. H. 1989. Insectos y Ácaros de importancia
Agrícola y
cuarentenaria
en Chile. Santiago. Universidad de Chile. 309p.
GONZÁLEZ,
H., et al. 2000. Plagas del aguacate. El aguacate y su
manejo
integrado. Ed. Télez
Daniel. México. Mundi Prensa. pp: 115-136.
GORDON,
R. D., ANDERSON, D. M. 1979. The genus Stethorus Weise
(Coleotera:
Coccinellidae) in Chile. The
Coleopterists Bulletin, 33(1):
61-67.
HOUCK,
M. A. 1991. Time and Resource Partitioning in Stethorus punctum
(Coleoptera:
Coccinellidae). Environmental
Entomology 20(2): 494-497.
HULL,
L. 1995. Know Your Friends: Stethorus punctum. Midwest Biological
Control
News Online 2(12).
www.nysaes.cornell.edu.
LÓPEZ,
E. 1991. El problema de los ácaros (arañitas) en
los años secos en
hortalizas
y frutales. Empresa y Avance
agrícola 1(4): 6-8.
LÓPEZ,
E. 1997. El clima: principal factor regulador de poblaciones de plagas.
Empresa
y Avance agrícola 7(53): 8-9.
LÓPEZ,
E. 1998. Manejo integrado de plagas del
palto. Sociedad
Gardiazábal
y
Magdahl. Seminario Internacional de
paltos. Viña del Mar 4, 5 y 6 de
Noviembre 1998.
pp.105-119.
MAGDAHL,
C. 1998. La industria de la Palta en Chile. Sociedad Gardiazábal y
Magdahl. Seminario
Internacional de paltos. Viña del
Mar 4, 5 y 6
de noviembre 1998. pp.
1-17
McMURTRY,
J. A., JOHNSON, H. G. 1966. An ecological study of the
spider
mite
Oligonychus punicae (Hirst) and Its
natural enemies. Hilgardia 37(11):
363-402.
McMURTRY,
J. A., JOHNSON, H. G. 1967. Preliminary Studies on
releasing
Stethorus
beetles for control of the avocado brown mite. California Avocado Society Yearbook 51:
173-176.
McMURTRY,
J. A., JOHNSON, H. G., and SCRIVEN, G. T.
1969.
Experiments
to
determine effects of mass releases of Stethorus picipes on the level of infestation of the
avocado brown mite. Journal of Economic Entomology 62(5):
1216-1221.
McMURTRY,
J. A., JOHNSON, H. G., and GUSTAFSON, C. D. 1972. Further
studies
on control of avocado brown Mite with releases of Stethorus picipes. California Avocado Society Yearbook 55:
128-133.
McMURTRY,
J. A., SCRIVEN, G. T., and MALONE R. S.
1974. Factors
Affecting Oviposition of Stethorus
picipes (Coleoptera:
Coccinellidae), with Special Reference to
Photoperiod.
Environmental
Entomology 3(1): 123-127.
PRADO,
E. 1991. Artrópodos y sus enemigos naturales Asociados a plantas
cultivadas
en Chile. Santiago. Instituto de Investigaciones
Agropecuarias. 207p.
PUTMAN,
Wm. 1955. Bionomics of Stethorus punctillum Weise (Coleoptera:
Coccinellidae)
in Ontario. The Canadian
Entomologist 87: 9-33.
ROJAS,
S. 1981. La arañita del palto y del chirimoyo;
Problemas en la V
Región. Investigación y Progreso Agropecuario La
Platina (4): 16-17.
TANIGOSHI,
L. K., and MCMURTRY, J. A. 1977.
The dynamics of predation of
Stethorus picipes (Coleoptera.
Coccinellidae) and Typholodromus
floridanus on the prey Oligonychus punicae (acarina:
Phytoseiidae,
Tetranychidae). Hilgardia
45: 237-288.
VERA,
S. 1994. Estudios preliminares sobre la arañita
roja del palto
Oligonychus
yotthersis Mc
Gregor (Acarina: Tetranychidae) y sus depredadores Stethorus histrio Chazeau (Coleoptera:
Coccinellidae) y Oligota pygmaea
Solier (Coleoptera: Staphylinidae).
Tesis Ing. Agro. Quillota,
Universidad Católica de Valparaíso, Facultad de Agronomía. 72p.